Atom memiliki kecenderungan untuk mencapai kestabilan dengan cara
berikatan dengan atom lain. Elektron yang berperan pada pembentukan
ikatan kimia adalah elektron valensi dari suatu atom/unsur yang
terlibat. Salah satu petunjuk dalam pembentukan ikatan kimia adalah
adanya golongan unsur yang stabil yaitu golongan VIIIA atau golongan 18
(gas mulia). Oleh sebab itu dalam pembentukan ikatan kimia, atom-atom
akan membentuk konfigurasi elektron seperti pada unsur gas mulia.
Unsur gas mulia mempunyai elektron valensi sebanyak 8 (oktet) kecuali Helium 2 (duplet), seperti terlihat pada table di bawah ini.
Kecenderungan unsur-unsur untuk menjadikan konfigurasi elektronnya
sama seperti gas mulia terdekat dikenal dengan istilah Aturan Oktet.
Untuk mengilustrasikan ikatan kimia dapat dilakukan dengan menuliskan
rumus Lewis dan rumus ikatan.
Ikatan kimia dibedakan menjadi 4 yaitu :
Ikatan kovalen terdiri dari :
Unsur gas mulia mempunyai elektron valensi sebanyak 8 (oktet) kecuali Helium 2 (duplet), seperti terlihat pada table di bawah ini.
| Periode | Unsur | Nomor Atom | K | L | M | N | O | P |
| 1 | He | 2 | 2 | |||||
| 2 | Ne | 10 | 2 | 8 | ||||
| 3 | Ar | 18 | 2 | 8 | 8 | |||
| 4 | Kr | 36 | 2 | 8 | 18 | 8 | ||
| 5 | Xe | 54 | 2 | 8 | 18 | 18 | 8 | |
| 6 | Rn | 86 | 2 | 8 | 18 | 32 | 18 | 8 |
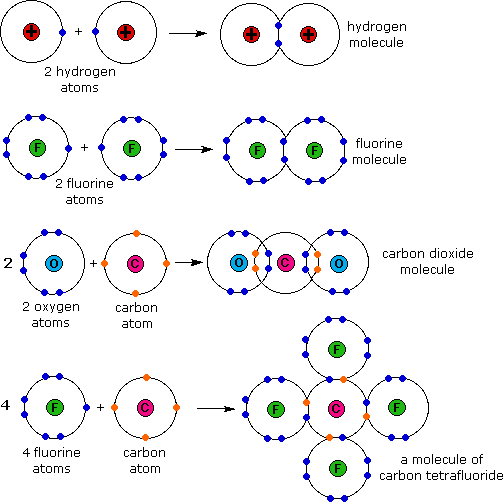
Ikatan kimia dibedakan menjadi 4 yaitu :
Ikatan kovalen terdiri dari :
- Ikatan kovalen tunggal
- Ikatan kovalen rangkap dua
- Ikatan kovalen rangkap tiga
- Ikatan kovalen polar
- Ikatan kovalen non polar

No comments:
Post a Comment